Science:为什么某些感染会让你对食物产生过敏?
来源:生物探索 2024-12-23 11:51
该研究为从基础免疫学到临床应用搭建了一座桥梁。通过进一步优化LIPSTIC技术、深入理解DC亚群的功能,并将研究结果转化为创新疗法,我们有望更有效地应对免疫相关疾病的挑战。
在我们的日常生活中,免疫系统时刻承担着一道复杂而重要的平衡任务:它既需要对食物、共生微生物等外界无害物质产生耐受性,又要对入侵的病原体发起有效的防御反应。然而,这一精密平衡的实现依赖于抗原递呈细胞(antigen-presenting cells, APCs)与T细胞之间的紧密协作。尤其是在肠道中,APC通过捕获食物抗原或微生物抗原,将它们递呈给CD4+ T细胞,并诱导后者分化为具有调节作用的外周调节性T细胞(peripheral regulatory T cells, pTregs),从而实现对抗原的免疫耐受。但一旦这种机制受到干扰,可能引发食物过敏、自身免疫疾病等免疫失调相关问题。
尽管已有研究揭示了肠道中某些APC亚群(如迁移性树突状细胞和RORγt+ APC)在诱导食物抗原特异性pTregs中的作用,但这些发现仍受限于传统基因敲除策略的技术壁垒,比如标记效率低下或其他APC亚群的功能补偿。为了突破这一瓶颈,12月19日Science的研究报道“Identification of antigen-presenting cell–T cell interactions driving immune responses to food”,研究团队开发并应用了一种名为“基于LIPSTIC技术的细胞标记系统”。该方法利用分子接触标记技术,通过在APC和T细胞相互作用时特异性标记参与递呈的APC,精准地识别了能够与特定T细胞发生作用的APC亚群。这一技术避免了以往方法中由于非特异性免疫反应带来的干扰,为深入研究APC与T细胞相互作用提供了全新的工具。
该研究通过LIPSTIC技术,重点分析了肠道树突状细胞(dendritic cells, DCs)在食物抗原递呈中的关键角色。结果表明,迁移性DC而非驻留性DC主导了对食物抗原的递呈,并且这些迁移性DC具有内在的耐受性功能,能够诱导食物抗原特异性Foxp3+ Tregs的分化。此外,研究还揭示了感染等外界因素如何通过影响DC亚群的功能和比例,破坏这一免疫耐受机制。该研究不仅深化了我们对食物抗原免疫耐受的细胞与分子机制的理解,也为开发相关疾病(如食物过敏和肠道炎症)新的治疗策略提供了重要线索。

免疫系统的巧妙平衡:宽容与防御的双重挑战
我们的免疫系统就像一位经验丰富的“指挥官”,需要在复杂的环境中协调多方力量,既要对入侵的病原体进行快速而精准的防御,又要对无害的物质,如食物和肠道内的共生微生物,保持耐受。这种平衡极为精妙,稍有失衡,便可能引发一系列问题,比如食物过敏、肠道炎症甚至自身免疫疾病。那么,免疫系统是如何做到这点的呢?答案就在抗原递呈细胞(APCs)与T细胞的相互作用中。
在肠道环境中,APCs扮演着“哨兵”的角色,捕获食物抗原并递呈给CD4+ T细胞。这个过程中,APCs决定了免疫系统是“视而不见”,引发免疫耐受,还是“拉响警报”,激活炎症反应。研究表明,肠道的经典树突状细胞(dendritic cells, DCs)在这种双向调控中发挥了关键作用。尤其是迁移性DC,它们将肠道中的食物抗原运送到肠道引流淋巴结(gut-draining lymph nodes, gLNs),并诱导外周调节性T细胞(pTregs)的生成,而这些pTregs正是维持免疫耐受的关键细胞类型。
然而,这种微妙的平衡并非牢不可破。当外界因素,如肠道感染或环境应激出现时,APC的功能可能会发生改变。该研究显示,在正常情况下,迁移性DC的生物素标记率约为2%-3%,并且能有效诱导Treg细胞分化。然而,当感染或其他免疫挑战干扰了DC亚群的比例时,这一平衡会被打破。例如,迁移性DC的比例显著减少时,Foxp3+ Treg的生成能力也随之降低,进而可能导致免疫耐受的失败。
这种免疫平衡的维持并非仅仅是分子和细胞层面的简单互动,而是一种动态的协作,依赖于多种信号的精确传递。
谁是关键使者?揭示抗原递呈细胞的角色
在免疫系统的复杂网络中,抗原递呈细胞(antigen-presenting cells, APCs)就像一个“桥梁”,将外界抗原信息传递给T细胞,从而决定免疫系统的响应方向。它们不仅是免疫反应的启动者,更是免疫耐受的守护者,确保身体不会对无害的食物抗原或肠道共生菌发动不必要的攻击。然而,尽管APC的重要性广为人知,其在肠道免疫耐受中的具体机制仍然存在许多未解之谜。
该研究为这一领域提供了重要线索。研究表明,肠道的树突状细胞(dendritic cells, DCs)是维持免疫耐受的关键APC亚群。尤其是迁移性DC,它们能够将肠道中的食物抗原传递到肠道引流淋巴结(gut-draining lymph nodes, gLNs),并通过递呈抗原诱导外周调节性T细胞(peripheral regulatory T cells, pTregs)的分化。这些Foxp3+ Treg细胞随后通过抑制其他免疫细胞的活性,防止炎症反应的发生,确保食物抗原的耐受性。
然而,现有研究中的不足也引发了新的思考。传统的基因敲除技术虽然揭示了某些APC亚群的重要作用,但这些方法往往存在特异性不足、靶点效率低以及功能补偿等问题。正因如此,研究人员无法准确捕捉到APC在免疫耐受过程中的具体动态。
为了解决这一难题,该研究采用了一种名为LIPSTIC的创新技术。这一方法利用生物素标记,实现了对参与抗原递呈的DC的精准识别。数据显示,当小鼠接受食物抗原(如OVA)后,迁移性DC的生物素标记率显著增加,而驻留性DC几乎没有标记,进一步确立了迁移性DC在肠道免疫中的核心作用。
突破传统:LIPSTIC技术的诞生与创新
免疫学研究中的一个长期挑战是如何精准追踪抗原递呈细胞(APCs)与T细胞的互动过程。传统的方法,如基因敲除或染料标记,虽然在揭示APC功能方面取得了一定成效,但却存在明显局限。其特异性不足、标记效率低,以及可能导致其他细胞补偿功能的现象,使得研究人员难以全面了解APC如何在真实生理条件下调控免疫响应。这一困境促使研究人员开发出一种更精准、更高效的研究工具——LIPSTIC技术。
LIPSTIC(Labeling Immune Partnerships by SorTagging Intercellular Contacts)是一种基于分子接触的标记技术,专为识别活体中正在进行抗原递呈的APC而设计。其原理简单而巧妙:研究人员将CD40L(一种由活化T细胞表达的分子)与Sortase A(SrtA,一种能催化生物素底物转移的酶)结合,同时将CD40(一种APC表面受体)与其底物LPETG融合。当T细胞与APC接触时,SrtA会将生物素标记转移到APC表面,从而使参与递呈的细胞“打上标记”,研究人员随后可以通过流式细胞术对这些生物素阳性(Biotin+)的细胞进行精确检测。
这一技术的创新之处在于,其不仅能够精准捕捉到特定APC亚群与T细胞的动态互动,还能避免传统方法中因非特异性反应导致的背景干扰。例如,在该实验中,研究团队通过LIPSTIC技术发现,食物抗原(如OVA)主要由迁移性树突状细胞(DCs)递呈,而驻留性DC几乎没有参与抗原递呈。这种高分辨率的标记能力帮助研究人员明确了不同DC亚群在免疫耐受中的分工。
此外,LIPSTIC还能通过动态时间窗口揭示APC-T细胞互动的具体时机和特点。研究显示,迁移性DC在接触食物抗原后,其标记率约为2%-3%,并能成功诱导Foxp3+调节性T细胞(Treg)分化,而这一过程依赖于CD40-CD40L的相互作用。相比之下,使用CD40L阻断抗体则完全抑制了标记过程,进一步验证了LIPSTIC的特异性。
LIPSTIC技术的诞生,为深入研究APC在免疫耐受与炎症反应中的作用开辟了全新的途径。它不仅克服了传统技术的局限性,更为复杂免疫调控机制的探索提供了有力工具。
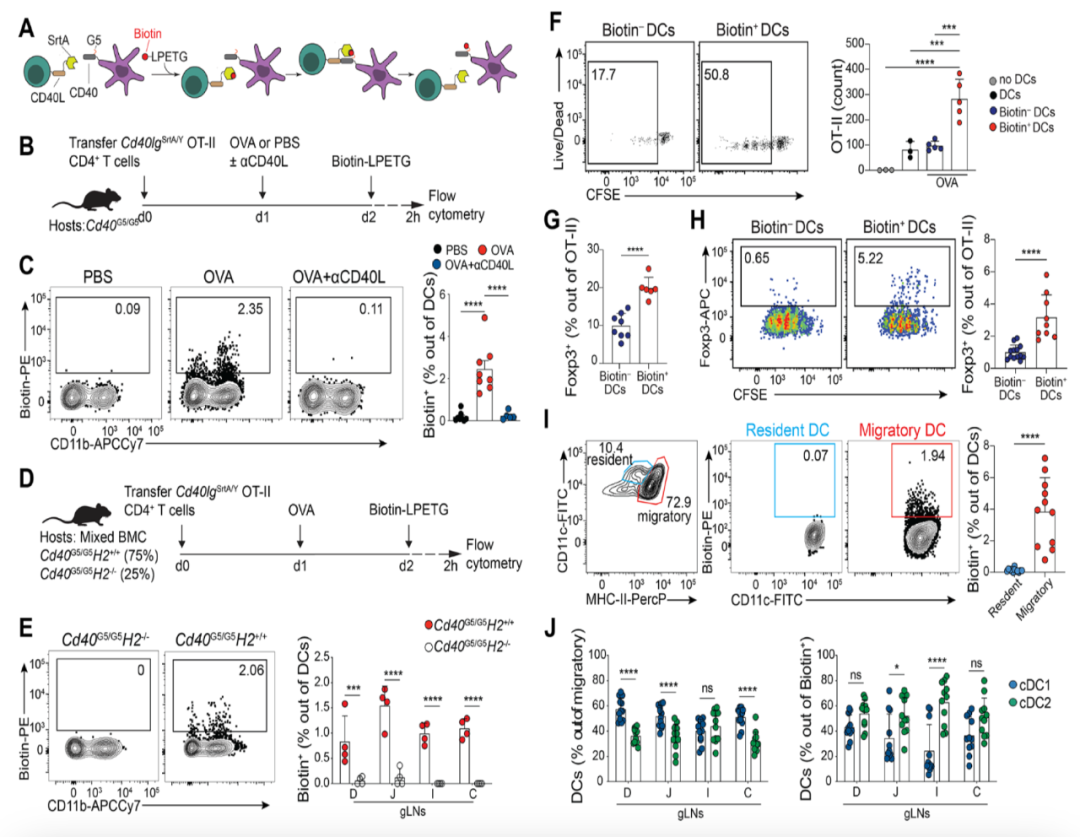
使用LIPSTIC技术识别在肠道引流淋巴结(D-gLNs)中递呈食物抗原的DC(Credit: Science)
(A) LIPSTIC技术的原理示意图
展示了LIPSTIC技术如何通过在CD40-CD40L分子间的相互作用中引入生物素标记,精准识别与T细胞接触的DC。这种技术能特异性地标记在体内递呈抗原的DC,而不会被其他并行的免疫响应干扰。
(B-C) LIPSTIC技术验证:PBS、OVA和OVA + αCD40L条件下的DC标记
实验设计(B):在CD45.2背景小鼠中转移CD45.1 OT-II T细胞后,分别给予PBS、OVA或OVA联合CD40L阻断抗体(αCD40L)。结果(C):PBS组中DC标记率极低(<0.1%),说明没有抗原递呈发生。OVA组中标记率显著升高至2-3%,表明迁移性DC参与了OVA抗原的递呈。αCD40L阻断组的标记率显著降低,进一步验证CD40-CD40L相互作用对抗原递呈的关键性。
(D-E) 混合骨髓嵌合体(BMC)小鼠实验:验证递呈依赖MHC-II
实验设计(D):将表达MHC-II的Cd40 G5/G5细胞和MHC-II缺失(H2-/-)细胞混合重建骨髓嵌合小鼠,再转移OT-II T细胞并给予OVA。结果(E):仅表达MHC-II的DC可以被标记为生物素阳性(Biotin+)。验证了DC递呈抗原过程中MHC-II的必要性。
(F-G) LIPSTIC标记的DC能诱导T细胞增殖与Treg分化
实验设计:将标记为Biotin+或Biotin-的DC与CFSE标记的OT-II T细胞共同培养,分析T细胞的增殖和Foxp3+ Treg分化。结果(F):Biotin+ DC能显著诱导OT-II T细胞增殖,而Biotin- DC效果有限。Biotin+ DC诱导的Foxp3+ Tregs比例显著高于Biotin- DC。结果(G):加入外源性OT-II肽后,Biotin+ DC仍表现出更强的诱导Treg分化能力,进一步表明LIPSTIC标记的DC具有内在的免疫调节能力。
(H-J) 驻留性DC与迁移性DC的功能对比
结果(I):迁移性DC(MHC-II^hi)的标记比例显著高于驻留性DC(MHC-II^int)。验证了迁移性DC在抗原递呈中的主导地位。结果(J):在总迁移性DC中,cDC1和cDC2比例接近1:1。在LIPSTIC标记的Biotin+ DC中,cDC1和cDC2的比例保持一致,表明两者均能有效递呈食物抗原。
迁移性树突状细胞:肠道免疫的幕后英雄
在复杂的肠道免疫网络中,迁移性树突状细胞(migratory dendritic cells, DCs)就像一位默默无闻却无可替代的幕后英雄。它们不仅是食物抗原的“搬运工”,还通过精准的抗原递呈机制,决定了免疫系统是“保持冷静”还是“发动攻击”。近年来的研究逐渐揭示,迁移性DC在肠道免疫耐受中的角色尤为重要。
该研究通过LIPSTIC技术,首次清晰地证明了迁移性DC在递呈食物抗原中的核心作用。实验显示,当小鼠接受卵清蛋白(OVA)作为模型抗原时,仅约2%-3%的DC被成功标记为生物素阳性(Biotin+),而这些Biotin+细胞主要是迁移性DC。在体外共培养实验中,只有这些标记的迁移性DC能够有效诱导CD4+ T细胞的增殖,并促进Foxp3+调节性T细胞(Tregs)的分化。相比之下,未标记的DC(Biotin−)尽管能诱导T细胞增殖,却无法推动Treg的生成。
更有趣的是,迁移性DC的作用不仅仅停留在抗原递呈上。研究发现,它们还通过表达特定分子(如TGF-β2和整合素β8)为Treg的分化提供必要的微环境。这些分子通过调节T细胞的活性,让免疫系统对食物抗原“网开一面”,从而避免不必要的免疫反应。而驻留性DC(resident DCs)则表现出完全不同的功能倾向,它们对食物抗原几乎“视而不见”,标记率接近于零,进一步凸显了迁移性DC在免疫耐受中的独特地位。
此外,迁移性DC的作用并非孤立进行,而是通过迁移至肠道引流淋巴结(gut-draining lymph nodes, gLNs)发挥作用。该研究的数据表明,这些迁移性DC具有较高的MHC-II表达水平(MHC-II^hi),并且更容易与T细胞直接接触,从而更高效地递呈抗原。研究进一步揭示,迁移性DC的缺失会显著降低Foxp3+ Treg的比例,导致免疫耐受的破坏,为肠道炎症和过敏反应埋下隐患。
迁移性DC在肠道免疫系统中发挥了不可替代的“双重角色”:它们既是抗原递呈的核心枢纽,也是诱导免疫耐受的关键调节者。
驻留性细胞的旁观者角色?看清不同DC亚群的分工
在免疫系统这个复杂的舞台上,并非每个角色都直接参与到关键的免疫决策中。例如,驻留性树突状细胞(resident dendritic cells, DCs)便更多地扮演着“旁观者”的角色,与迁移性DC形成了鲜明对比。尽管它们也被归为抗原递呈细胞(APCs),但其在食物抗原递呈和免疫耐受诱导中的功能却远不及迁移性DC重要。
该研究通过LIPSTIC技术首次清晰地揭示了驻留性DC的局限性。当小鼠接受卵清蛋白(OVA)作为抗原时,驻留性DC的生物素标记率极低,几乎为零。这表明,在递呈食物抗原的过程中,驻留性DC的参与度极低。而与之形成鲜明对比的是,迁移性DC的标记率高达2%-3%,并且它们在后续实验中被证实能够显著诱导CD4+ T细胞的增殖以及Foxp3+调节性T细胞(Tregs)的分化。
为何驻留性DC在这一过程中显得如此“低调”?研究发现,这主要与其功能定位和生物学特性有关。驻留性DC通常分布于肠道引流淋巴结(gLNs)中,主要负责处理静态环境中的分子信号,而不是主动捕获和递呈外来抗原。相比之下,迁移性DC则通过不断在肠道黏膜和淋巴结之间穿梭,将肠道中的食物抗原带到gLNs中递呈给T细胞,这种动态的迁移能力使其成为抗原递呈的核心枢纽。
此外,驻留性DC在分子表达层面也有所不同。例如,研究发现,迁移性DC具有更高的MHC-II表达水平(MHC-II^hi),这使得它们在递呈抗原时效率更高。相反,驻留性DC虽然具有一定的MHC-II表达,但主要维持在中等水平(MHC-II^int),从而限制了它们与T细胞互动的能力。
这些发现揭示了肠道免疫系统中不同DC亚群的分工与协作。驻留性DC虽然不像迁移性DC那样在免疫耐受中扮演核心角色,但它们可能在其他方面具有重要作用,例如监测淋巴结中的内在环境或维持静态免疫状态。正是这种分工协作,确保了免疫系统的高效运行,也进一步强调了迁移性DC在食物抗原免疫耐受中的不可或缺性。
感染的冲击波:肠道免疫如何被破坏?
肠道免疫系统虽然高效而精密,但也极为脆弱。感染,就像一颗投掷到免疫平衡中的“冲击波”,可以迅速扰乱肠道环境,影响抗原递呈细胞(APCs)的比例,最终削弱调节性T细胞(Tregs)的分化,破坏免疫耐受。该研究揭示了感染对DC亚群功能的深远影响,尤其是在迁移性树突状细胞(DCs)和驻留性DCs之间的平衡方面。
研究通过感染小鼠模型发现,寄生虫感染(如强壁芽线虫 Strongyloides venezuelensis, S.v.)会显著改变DC亚群的比例。在健康状态下,迁移性DC占据主导地位,是递呈食物抗原并诱导Foxp3+ Tregs分化的关键细胞。然而,当感染发生时,迁移性DC的数量和功能显著下降。在S.v.感染的峰值期,研究发现迁移性DC的比例几乎降至零,与T细胞的抗原递呈互动也随之大幅减少。这直接导致Foxp3+ Tregs的分化严重受阻,使得肠道免疫耐受的维持成为不可能。
更令人担忧的是,感染还会通过扩增促炎症的DC亚群(如cDC2)进一步恶化免疫失衡。数据显示,在感染小鼠中,cDC2的数量显著增加,这些细胞尽管能够诱导T细胞的增殖,却倾向于激活炎症性Th2细胞,而非调节性T细胞。这种“促炎细胞”与“耐受细胞”的比例失调,使得肠道环境更加倾向于炎症,而非耐受。
实验显示,在S.v.感染小鼠的肠道引流淋巴结(gLNs)中,几乎所有递呈食物抗原的APCs都丧失了诱导Tregs的能力。而当S.v.感染清除后,迁移性DC的比例逐渐恢复,Treg的分化能力也得以重建,这表明这种失衡是感染驱动的动态过程。
这些发现突出了感染对肠道免疫系统的破坏性影响。感染不仅直接削弱了迁移性DC的功能,还通过改变DC亚群比例,使免疫系统从耐受模式转向促炎模式。这种破坏不仅可能导致食物过敏,还可能加剧肠道炎症疾病的风险。
从平衡到失衡:理解食物过敏与自身免疫的根源
免疫系统的平衡犹如一根精心调校的天平,一旦失衡,就可能引发严重后果,比如食物过敏和自身免疫性疾病。该研究揭示了肠道免疫耐受的核心机制,同时也为这些疾病提供了全新的视角,特别是在理解失衡如何导致免疫系统对无害的食物抗原和自身组织发动“错误攻击”方面。
研究表明,迁移性树突状细胞(migratory DCs)在递呈食物抗原并诱导调节性T细胞(Tregs)生成的过程中发挥了至关重要的作用。这些Tregs通过抑制免疫反应,确保免疫系统对食物抗原保持耐受。然而,当外界因素(如感染或环境应激)导致迁移性DC的数量减少或功能受损时,这一免疫耐受机制便会瓦解。数据显示,在感染条件下,迁移性DC的比例显著下降,Foxp3+ Tregs的生成也随之减少。相应的,免疫系统对食物抗原的耐受性丧失,进而可能触发过敏性反应。
更重要的是,感染还可能通过扩增促炎DC亚群(如cDC2),进一步推动免疫系统从耐受状态转向炎症状态。这种炎症性DC不仅无法递呈食物抗原,反而倾向于激活效应性T细胞(如Th2细胞),诱发异常的免疫反应。这一机制可能是食物过敏等免疫相关疾病的重要诱因之一。
与此同时,自身免疫疾病也与类似的免疫失衡有关。当迁移性DC的功能受损或比例下降时,Tregs的生成不足,免疫系统对自身抗原的耐受性可能被破坏。这种耐受性障碍会导致免疫系统将自身组织误认为“敌人”,从而触发炎症和组织损伤。
该研究为食物过敏和自身免疫的发生机制提供了新的见解。它强调了APC亚群在免疫调控中的动态角色,尤其是迁移性DC与Tregs之间的关键联系。
免疫学的未来:从基础研究到临床应用
随着技术的发展,免疫学的研究不断揭示出人体免疫系统的复杂性与精妙性。该研究不仅深化了我们对肠道免疫耐受机制的理解,还为未来疾病的诊断与治疗提供了崭新的视角。从抗原递呈细胞(APCs)与调节性T细胞(Tregs)的互动,到感染对免疫系统的破坏,这些发现描绘了一幅从基础研究到临床应用的清晰路径。
首先,研究中提出的LIPSTIC技术展示了其强大的研究潜力。这种方法能够精准识别特定亚群的抗原递呈细胞,揭示其在免疫调控中的动态作用。在基础研究中,这项技术可以帮助研究人员探索更多免疫相关细胞的功能与机制;而在临床中,它或许可以发展为一种诊断工具,用于检测肠道或其他组织中异常的免疫活动。例如,通过追踪递呈特定抗原的DC亚群,医生可以更早期地发现免疫失衡的迹象,为疾病的早期干预提供依据。
其次,这项研究揭示了感染如何影响迁移性DC的功能以及Tregs的生成,这为开发靶向疗法指明了方向。例如,通过调控迁移性DC的数量或功能,可以恢复肠道免疫耐受,从而治疗或预防食物过敏、炎症性肠病等疾病。此外,针对感染导致的促炎症DC亚群扩增,研究人员可以研发特异性抑制剂,以阻止炎症反应的过度激活,从而缓解慢性炎症相关疾病的症状。
此外,Tregs的生成机制为免疫疗法开辟了新的领域。通过增强迁移性DC诱导Tregs的能力,或直接注射人工培养的Tregs,有可能为治疗自身免疫性疾病(如1型糖尿病或克罗恩病)提供创新性解决方案。这种免疫调节策略还可能应用于器官移植中,降低排斥反应的风险。
综上,该研究为从基础免疫学到临床应用搭建了一座桥梁。通过进一步优化LIPSTIC技术、深入理解DC亚群的功能,并将研究结果转化为创新疗法,我们有望更有效地应对免疫相关疾病的挑战。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


